
O ácido clorídrico técnico gira em torno de 30-34% HCl, de acordo com
o meio de transporte e a minimização de perdas por evaporação.
- O ácido clorídrico (HCℓ) é uma solução aquosa, ácida e queimante, devendo ser manuseado apenas com as devidas precauções. Ele é normalmente utilizado como reagente químico, e é um dos ácidos que se ioniza completamente em solução aquosa. Em sua forma pura, HCℓ é um gás, conhecido como cloreto de hidrogênio.
Em sua forma de baixa pureza e com concentração não informada, é conhecido como ácido muriático (muriático significapertencente a salmoura ou a sal), sendo vendido sob essa designação para a remoção de manchas resultantes da umidade em pisos e paredes de pedras, azulejos, tijolos e outros. O ácido muriático, quando aquecido, libera vapores tóxicos e irritantes.
- Uma solução de cloreto de hidrogênio (ácido clorídrico), em sua forma mais pura, com a denominação de "P.A." (Pureza Analítica), também, conhecida no termo eurudita como "Limpido", é um reagente comum em laboratórios e encontrado em uma solução de 37 a 38% em massa.
Este ácido pode ser encontrado no estômago. Os sucos digestivos humanos consistem numa mistura bastante diluída de ácido clorídrico e várias enzimas que ajudam a clivar as proteínas presentes na comida.
- À temperatura ambiente, o cloreto de hidrogênio é um gás incolor a ligeiramente amarelado, corrosivo, não inflamável, mais pesado que o ar e de odor fortemente irritante. Quando exposto ao ar, o cloreto de hidrogênio forma vapores corrosivos de coloração branca. O cloreto de hidrogênio pode ser liberado pelos vulcões.
O cloreto de hidrogênio tem numerosos usos: se usa, por exemplo, para limpar, tratar e galvanizar metais, curtir couros, e na produção e refinação de uma grande variedade de produtos. O cloreto de hidrogênio pode formar-se durante a queima de muitos plásticos. Quando entra em contato com a umidade do ar forma o ácido clorídrico.
História:
- O ácido clorídrico foi descoberto em torno do ano 800 pelo alquimista Persa Jabir Ibn Hayyan (Geber), misturando sal comum com ácido sulfúrico (vitríolo):2NaCl + H2SO4
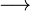 Na2SO4 + 2HCl
Na2SO4 + 2HCl
Jabir descobriu ou inventou um grande número de produtos químicos e relatou suas descobertas em mais de vinte obras, que permitiram a propagação de seus conhecimentos sobre o ácido clorídrico e de outros produtos químicos através dos séculos. A água régia, sua invenção, uma mistura do ácido clorídrico com o ácido nítrico, permite dissolver o ouro e foi uma participação sua na famosa busca dos alquimistas pela pedra filosofal.
- Durante a Idade Média, pelo fato de ser obtido do sal comum, o ácido clorídrico era conhecido entre os alquimistas europeus como "espírito do sal" ou "ácido do sal". No estado gasoso era chamado de "ar ácido marinho". O nome ácido muriático tem a mesma origem (muriático significa "pertencente a salmoura ou a sal"). Basilius Valentinus, abade-alquimista da abadia de Erfurt (Alemanha), produziu quantidade relevante do ácido durante o século XV.
No século XVII, Johann Rudolf Glauber de Karlstadt am Main (Alemanha) utilizou sal (NaCℓ) e ácido sulfúrico para preparar sulfato de sódio (Na2SO4) e, como subproduto, obtinha-se cloreto de hidrogênio gasoso (HCℓ). Joseph Priestley de Leeds (Reino Unido) preparou cloreto de hidrogênio puro em 1772, e em 1818, Sir Humphry Davy (Reino Unido) demonstrou que este produto químico é constituído de hidrogênio e de cloro.
- Ao longo da Revolução Industrial, a demanda por substâncias alcalinas, notadamente de carbonato de sódio, aumentou fortemente na Europa, e o processo industrial desenvolvido por Nicolas Leblanc (de Issoudun, França) permitiu uma produção razoável deste composto em grande escala.
No processo Leblanc, o sal é transformado em carbonato de sódio utilizando como reagentes ácido sulfúrico, giz branco ou calcário e carvão, com uma produção secundária de cloreto de hidrogênio gasoso. Até a promulgação, em 1863, do Alkali Act no Reino Unido, o cloreto de hidrogênio era lançado diretamente à atmosfera. A partir da proibição imposta pelo Alkali Act, os produtores de carbonato de sódio foram obrigados a dissolver o gás em água, produzindo assim o ácido clorídrico em escala industrial.
- Quando o processo Leblanc foi substituído no início do século XX pelo processo Solvay, que não apresenta produção secundária de ácido clorídrico, o antes subproduto já era visto como um reagente químico importante para um grande número de aplicações. O interesse comercial em ácido clorídrico contribuiu para a emergência de outras técnicas de produção, que são utilizadas atualmente.
O ácido clorídrico é citado como um precursor bioquímico, na Tabela 2 da Convenção das Nações Unidas contra o Tráfico Ilícito de Entorpecentes e de Substâncias Psicotrópicas de 1988, pelo fato de ser usado na síntese de heroína e cocaína.
Produção industrial
Síntese direta:
- A produção em grande escala do ácido clorídrico é quase sempre integrada com outra produção química de escala industrial. No processo industrial de cloro-álcali, uma solução de sal sofre eletrólise, produzindo gás cloro, gás hidrogênio e hidróxido de sódio. Por combustão do hidrogênio em ambiente clorado ocorre a formação do cloreto de hidrogênio, da seguinte forma:
- Como a reação é exotérmica, o reator químico neste processo se chama forno de ácido clorídrico. O cloreto de hidrogênio resultante é absorvido em água desmineralizada e forma-se assim ácido clorídrico quimicamente puro.
Síntese orgânica:
- Atualmente, boa parte do ácido clorídrico industrial é produzida juntamente com a formação de compostos orgânicos clorados e fluoretados, como por exemplo Teflon, Freon e outros CFCs, ácido cloroacético e PVC.
- A formação do ácido clorídrico ocorre pela substituição de átomos de hidrogênio nos compostos orgânicos por átomos de cloro, da seguinte forma:
- O cloreto de hidrogênio resultante pode ser absorvido em água, com a formação de ácido clorídrico técnico.
Mercado
- O ácido clorídrico é produzido em soluções com até 38% HCℓ (ácido clorídrico concentrado). O ácido clorídrico técnico gira em torno de 30-34% HCℓ, de acordo com o meio de transporte e a minimização de perdas por evaporação. As soluções de ácido muriático para uso doméstico têm no máximo 10-12% HCℓ e recomenda-se diluí-las antes do uso.
Os maiores produtores mundiais incluem a Dow Chemical, FMC, Georgia Gulf Corporation, Tosoh Corporation, AresClean, Akzo Nobel e Tessenderlo. A produção mundial total é estimada em 20 milhões de toneladas por ano, com 3 milhões mediante a síntese direta e o restante como subproduto de síntese orgânica.
- O ácido clorídrico é encontrado em vários produtos de limpeza de pisos.
- É muito usado também em soluções acidificantes para aquários com peixes ornamentais.
Cloreto de hidrogênio:
- O cloreto de hidrogênio é irritante e corrosivo para qualquer tecido com que tenha contato. A exposição a níveis baixos produz irritação na garganta e nariz. Em níveis mais elevados pode levar até ao estreitamento dos bronquíolos, acumulando líquidos nos pulmões, podendo levar a morte.
Dependendo da concentração, o cloreto de hidrogênio pode produzir desde uma leve irritação até queimaduras graves na pele e olhos.

O ácido clorídrico impuro é o ácido muriático usado na limpeza de azulejos
Derrame de ácido clorídrico obriga à evacuação de dois armazéns
em Coimbra em Portugal
O Ácido Clorídrico:
- O ácido clorídrico é formado pelo gás cloreto de hidrogênio (HCl) dissolvido em água, numa proporção de cerca de 37% do gás. É um ácido inorgânico forte, líquido levemente amarelado, em que seus cátions H+são facilmente ionizáveis na solução. A 18ºC o grau de ionização do ácido clorídrico, isto é, a porcentagem de hidrogênios que efetivamente sofrem ionização é de 92,5%.
Seu frasco deve ser mantido bem fechado, pois na forma pura essa solução libera vapores de HCl, sendo sufocante e muito tóxico. O ponto de ebulição desse ácido é de -85ºC, sendo considerado volátil, o que significa que ele passa facilmente para o estado de vapor em condições ambientes.
- Além disso, se não permanecer fechado, a sua concentração pode variar, visto que ele é altamente higroscópico, ou seja, absorve com facilidade a água da atmosfera.
O ácido clorídrico é muito usado na limpeza e galvanização de metais, no curtimento de couros, na obtenção de vários produtos, como na produção de tintas, de corantes, na formação de haletos orgânicos, é usado também na hidrólise de amidos e proteínas pelas indústrias alimentícias e na extração do petróleo, dissolvendo as rochas e facilitando o seu fluxo até a superfície.
- Ele pode ser encontrado também em nosso próprio organismo, estando presente no suco gástrico do estômago, cuja ação é ajudar na digestão dos alimentos. Ele é secretado pelo estômago num volume aproximado de 100 mL. Algumas pessoas sofrem de refluxo gastroesofágico, que é o retorno do conteúdo do ácido clorídrico do estômago, como mostrado abaixo. Ele provoca queimação, rouquidão e dor torácica.
Na sua forma impura, o ácido clorídrico é chamado de ácido muriático e é usado para a limpeza de pisos, azulejos, paredes de pedras e superfícies metálicas antes do processo de soldagem. Visto que o ácido muriático apresenta vapores tóxicos e irritantes quando aquecidos, é preciso que a pessoa que for manuseá-lo o faça com bastante cuidado, usando máscara de respiração, luvas e óculos de proteção.
- Não deve ser utilizado perto de rios e lagos, pois é prejudicial à vida aquática. Concentrações elevadas diminuem o pH do meio, sendo prejudicial também às bactérias oxidantes por inibir a demanda de oxigênio.
Quantidades consideráveis de ácido clorídrico ocorrem em gases
emitidos de vulcões especialmente do México e America do Sul.
